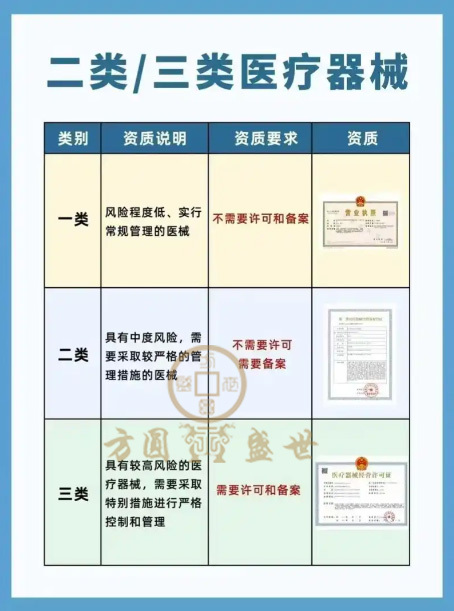
第三类医疗器械因其高风险性(如植入人体、用于支持/维持生命、可能对人体有潜在危险等),其经营许可证(即《医疗器械经营许可证》)的核发和监管要求严格。根据《医疗器械监督管理条例》(国务院令第739号)、《医疗器械经营监督管理办法》(国家市场监督管理总局令第54号)及相关配套文件,申请第三类医疗器械经营许可证需满足以下资质要求:
一、主体资格要求
企业类型:需为依法登记的法人企业(如有限责任公司、股份有限公司等),个体工商户不得从事第三类医疗器械经营(因风险较高,个体工商户的管理能力、责任承担能力有限)。
经营范围:企业营业执照的经营范围需明确包含“第三类医疗器械经营”相关表述(如“销售第三类医疗器械”等)。
信用记录:企业及其法定代表人、主要负责人无严重违法失信记录(如被列入经营异常名录、严重违法失信企业名单等)。
二、人员资质要求
人员是审核的核心,需确保具备专业能力和合规意识:
企业负责人:应熟悉医疗器械相关法律法规(如《医疗器械监督管理条例》《医疗器械经营质量管理规范》等),无《医疗器械监督管理条例》等规定的禁止从业情形(如因违法被吊销许可证未满5年等)。
质量负责人(关键岗位):
需具备医学、药学、医疗器械、生物医学工程、机械、电子等相关专业大专以上学历或中级以上专业技术职称;
需具有3年以上医疗器械经营质量管理工作经历(或相关行业经验,如药品、医疗器械生产等);
需全职在岗,不得兼职(部分地区要求质量负责人与企业签订劳动合同并缴纳社保)。
质量管理人员(根据经营范围配备):
至少1名质量负责人,若经营范围包含体外诊断试剂(如新冠病毒检测试剂),需额外配备主管检验师或具有检验学相关专业学历(大专以上)且从事检验相关工作3年以上的人员;
若经营范围包含植入类或介入类医疗器械(如心脏支架、人工关节),需配备与产品相关的专业技术人员(如临床医学、生物医学工程等)。
三、经营场所与库房要求
场所和库房需满足产品储存、运输的特殊要求,确保质量安全:
经营场所:
需为独立、固定的场所(不得为住宅或商住两用房),面积根据经营范围和地区要求不同(一般不少于30㎡,具体以当地药监部门要求为准);
场所内应配备办公设备(如电脑、打印机)、文件柜等,用于质量管理记录和文件管理。
库房:
需为独立库房(不得与经营场所混合,不得为住宅),面积根据经营范围和产品特性确定(如普通库房一般不少于50㎡,体外诊断试剂需冷库,面积不少于20㎡;部分地区要求更高);
库房应分区管理:设置“合格品区”“不合格品区”“待验区”“发货区”“退货区”等,并悬挂标识;
储存条件需符合产品说明书要求:
常温库:温度0-30℃,湿度35%-75%;
阴凉库:温度≤20℃,湿度35%-75%;
冷库(用于体外诊断试剂、冷藏医疗器械等):温度2-8℃,需配备备用发电机、温度监控系统(实时记录、报警功能);
需配备与储存产品匹配的设施设备:货架、托盘、避光设施(如遮光窗帘)、温湿度计(自动记录仪)、防鼠防虫设施(如挡鼠板、灭蝇灯)等;
若委托第三方物流企业储存、配送,需提供委托协议及第三方企业的资质(需具备《医疗器械经营许可证》且库房条件符合要求),但部分地区(如北京)要求企业需自有库房(体外诊断试剂除外)。
四、质量管理制度要求
需建立覆盖经营全流程的质量管理体系,确保可追溯和合规:
制度文件:需制定《医疗器械经营质量管理规范》要求的质量管理制度,至少包括:
采购管理制度(供应商审核、产品验收标准);
验收管理制度(到货检查、记录要求);
储存与养护管理制度(温湿度监控、库房清洁);
销售与售后服务管理制度(客户资质审核、退货处理);
不合格医疗器械管理制度(隔离、销毁);
不良事件监测与报告制度(发现可疑不良事件需及时上报);
追溯管理制度(实现产品从采购到销售的全流程可追溯);
计算机信息管理系统管理制度(数据备份、权限管理)。
记录与档案:需建立完整的记录(如采购记录、验收记录、销售记录、温湿度记录等),并保存至产品有效期满后2年(无有效期的保存不少于5年)。
详细信息可直接在线与客服联系,或电话咨询官方热线:400-090-3278
五、计算机信息管理系统要求
需配备符合医疗器械经营质量管理要求的计算机系统,实现以下功能:
全流程管理:覆盖采购、验收、储存、销售、运输、售后服务等环节,确保各环节数据可追溯;
数据记录:自动记录采购、验收、销售、库存等信息(如产品名称、规格、型号、批号、有效期、生产企业、供货者、购货者等),并支持查询和导出;
权限控制:设置不同岗位的操作权限(如采购、验收、销售权限分离),防止数据篡改;
接口对接:部分地区要求系统与药监部门的监管平台对接(如“医疗器械追溯系统”),实现数据实时上传。
六、其他特殊要求
特殊类别产品:
若经营体外诊断试剂(需冷藏/冷冻):需配备冷库(2-8℃)、冷藏车或冷藏箱(带温度记录仪)、备用发电机等,且质量负责人需具备检验学相关专业背景;
若经营植入类医疗器械(如人工心脏瓣膜、骨科植入物):需建立产品追溯系统,记录患者信息(如手术日期、植入部位等),并与医疗机构对接;
若经营角膜接触镜、助听器等产品:需配备验光师、听力师等专业技术人员(部分地区要求)。
申请材料:需提交《医疗器械经营许可证申请表》、营业执照、法定代表人/企业负责人身份证明、质量负责人资质证明、场所/库房证明(房产证或租赁合同)、设施设备清单、质量管理制度文件、计算机系统说明等。
七、申请流程(简要)
核名:取得企业名称预先核准通知书;
准备材料:按要求整理人员、场所、制度等材料;
提交申请:向所在地设区的市级药品监督管理部门提交(线上+线下);
现场核查:药监部门对经营场所、库房、人员等进行现场检查;
审批发证:符合要求后核发《医疗器械经营许可证》(有效期5年,到期前6个月申请延续)。
注意事项
不同地区(如北京、上海、广东等)可能对场所面积、人员要求有细化规定(如北京要求体外诊断试剂冷库面积≥20㎡,上海要求库房层高≥3米等),需以当地药监部门要求为准;
若企业同时经营第二类医疗器械(需备案),需在申请第三类许可证时一并办理备案;
严禁超范围经营(许可证载明的经营范围需与实际经营一致),否则将面临处罚(如吊销许可证、罚款等)。
建议申请前咨询当地药品监督管理部门(如市级市场监管局),确认具体要求,避免因材料不全或不符合标准导致延误。








